Contente
Todo ácido possui uma constante de dissociação característica (Kuma), que é uma medida de sua capacidade de doar íons hidrogênio em solução. Em outras palavras, Kuma fornece uma maneira de medir a força de um ácido. Valores maiores significam ácidos mais fortes. O pH (potência do hidrogênio) de uma solução é uma medida da concentração de íons hidrogênio e também é uma medida da acidez, mas não é o mesmo que Kuma. Existe uma relação entre os dois, e você pode calcular Kuma para um ácido, se você souber a concentração de ácido e o pH da solução.
Dissociação Constante Ka
Um composto é ácido se puder doar íons hidrogênio para uma solução aquosa, o que equivale a dizer que o composto é capaz de criar íons hidrônio (H30+) A equação geral que descreve o que acontece com um ácido (HA) em solução é:
HA + H20 <--> H30+ + A-, onde um- é a base conjugada.
Alguns ácidos são fortes e se dissociam completamente, enquanto outros são fracos e apenas parcialmente se dissociam. Você pode medir a força de um ácido por sua constante de dissociação Kuma, que é uma razão formada pela divisão da concentração de produtos pela concentração de reagentes:
Kuma = /
Todas as reações acontecem na água, portanto é geralmente excluída da equação.
Derivando Ka do pH
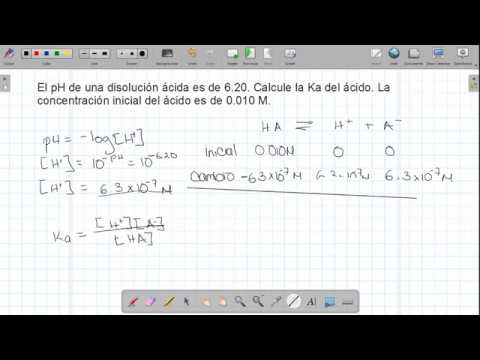
O pH de uma solução ácida aquosa é uma medida da concentração de íons livres de hidrogênio (ou hidrônio) que contém: pH = -log ou pH = log. A última equação pode ser reescrita:
= 10-pH
Se você conhece a concentração molar de uma solução ácida e pode medir seu pH, a equivalência acima permite calcular a concentração relativa de ácido para conjugar a base e derivar a constante de dissociação Kuma. Para fazer isso, ajuda a configurar uma tabela que delineia o Euconcentrações nitiais de reagentes e produtos, a Calterações nas concentrações e nas concentrações Equilibrium. Esta é uma tabela do ICE. Em vez de configurar uma de uma maneira geral, é mais instrutivo ilustrar o procedimento com um exemplo específico.
Constante de dissociação para ácido acético
O ácido acético, o ácido que dá ao vinagre seu sabor azedo, é um ácido fraco que se dissocia em íons acetato e hidrônio em solução.
CH3CO2H + H2O <--> CH3CO2− + H3O+
O vinagre doméstico típico é uma solução 0,9 M com um pH de 2,4. Usando os dados, é possível calcular a constante de dissociação:
Ácido acético (CH3CO2)H) Íons de hidrônio (H3O+) Íons de acetato (CH3CO2-)
Inicial 0,9 M 0 0
Alterar -x M + x M + x M
Equilíbrio (0,9 - x) M x M x M
A constante de dissociação Kuma é / .
Kuma = x2/(0,9 - x)
Como observado acima, = 10-pH. Como x = e você conhece o pH da solução, você pode escrever x = 10-2.4. Agora é possível encontrar um valor numérico para Ka.
Ka = (10-2.4)2 /(0.9 - 10-2.4) = 1,8 x 10-5.