Os átomos consistem em um núcleo denso, ou núcleo, que contém partículas carregadas positivamente chamadas prótons e partículas não carregadas chamadas nêutrons. Elétrons carregados negativamente ocupam regiões um pouco confinadas do espaço fora do núcleo chamado orbital. Prótons e nêutrons pesam quase 2.000 vezes mais que elétrons e, portanto, representam quase toda a massa de um átomo. Para qualquer elemento da tabela periódica, o número de prótons nos núcleos de seus átomos é consistente. Todo átomo de carbono, por exemplo, contém seis elétrons. O número de elétrons corresponde ao número de prótons em um átomo neutro, mas os átomos podem ganhar ou perder elétrons durante reações químicas. O número de nêutrons também varia de um átomo para o outro. Os químicos referem-se a átomos do mesmo elemento com números diferentes de nêutrons que isótopos. A compreensão desses termos representa a chave para determinar os prótons, nêutrons e elétrons em um isótopo.
Identifique o número de massa do isótopo a partir do seu símbolo. Por convenção, os cientistas declaram o número de massa de um isótopo como um número sobrescrito na frente do símbolo elementar, como 235U, ou com um hífen após o símbolo, como no U-235.
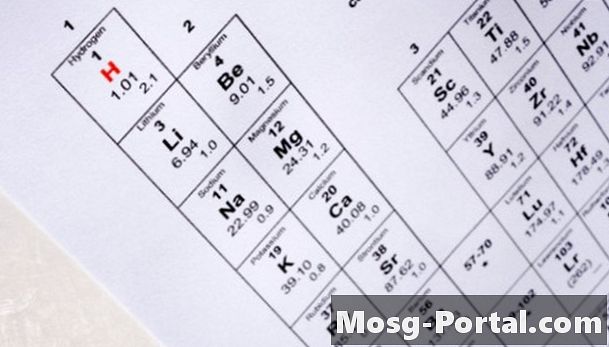
Determine o número de prótons no núcleo do isótopo localizando seu número atômico na tabela periódica dos elementos. A tabela periódica organiza elementos aumentando o número atômico. U, por exemplo, representa o símbolo químico do urânio e possui um número atômico de 92. Isso significa que todos os átomos de urânio contêm 92 prótons em seu núcleo.
Calcule o número de elétrons contidos pelo isótopo observando se seu símbolo inclui uma carga. A notação de carga representa um número positivo ou negativo, geralmente escrito como sobrescrito após o símbolo químico, como 235U (4+). Isso indica que o átomo de urânio perdeu quatro elétrons. Na ausência de uma carga declarada, o isótopo possui uma carga zero e seu número de elétrons é igual ao número de prótons. Subtraia cargas positivas ou adicione cargas negativas ao número atômico se o símbolo contiver uma carga declarada. O 235U (4+), por exemplo, conteria 92 - 4 = 88 elétrons.
Encontre o número de nêutrons no isótopo subtraindo o número de prótons do número de massa indicado no símbolo. Por exemplo, 235U, que contém 92 prótons, contém 235 - 92 = 143 nêutrons.